Содержание
- 1 Инфекция прииндопротезировании коленного сустава
- 2 Инфекция после протезирования коленного сустава
- 3 О ревизионном эндопротезировании коленного сустава: показания, противопоказания, особенности проведения
- 4 Хирургическое лечение параэндопротезной инфекции коленного сустава
Инфекция прииндопротезировании коленного сустава
Увеличение средней продолжительности жизни, несомненно, положительная тенденция настоящего времени, но обратной стороной медали является не всегда высокое качество жизни, особенно в старшем возрасте. Одним из факторов, снижающих это качество, всё чаще становятся заболевания суставов. Боль и ограничение способности к движению при этих заболеваниях со временем значительно осложняют жизнь пациентам. Наиболее эффективным способом лечения в этих случаях считается хирургическое вмешательство. Для лечения пациентов с тяжелыми посттравматическими осложнениями и дегенеративными заболеваниями суставов оптимальным методом считается эндопротезирование. Однако, несмотря на то что после тотального эндопротезирования коленного сустава наблюдается значительное улучшение состояния пациента, существует риск осложнения в виде парапротезной инфекции, при котором увеличиваются сроки и стоимость лечения. Кроме того, инфекционное осложнение может привести к неблагоприятному исходу хирургического лечения. Согласно исследованиям, проведенным в ряде разных центров, после тотального эндопротезирования коленного сустава инфицирование происходило в 0,5-5% случаев [1-3].
I. Uçkay с соавт. выполнили ретроспективный анализ 6101 случая реэндопротезирования крупных суставов с 1996 по 2008 г. Из них 2099 случаев – после эндопротезирования коленного сустава. Всего было удалено 234 (11,15%) протеза коленного сустава, из них по поводу инфекции удалено 24 (1,14%) протеза. Полученные результаты позволили авторам сделать вывод, что парапротезная инфекция – редкое осложнение [4; 5].
Внедрение эндопротезирования в клиническую практику в России происходило постепенно, и первоначальные результаты не внушали оптимизма. По данным H.Н. Корнилова с соавт., частота инфекционных осложнений в некоторых лечебных учреждениях, где выполнялось лишь несколько эндопротезирований в год, достигала 17% [5; 6].
Волошин В.П. с соавт. проанализировали опыт лечения 66 пациентов с тотальным эндопротезированием крупных суставов. В 87,9% случаев (58 пациентов), в сроки от 1,5 до 3 лет после эндопротезирования, отмечалось развитие гнойной инфекции. Глубокое нагноение отмечено у 6 пациентов (9,1%). В итоге 10 пациентам было выполнено артродезирование коленного сустава аппаратом Илизарова [5; 7].
Т.А. Куляба с соавторами проанализировали результаты лечения 44 пациентов, у которых после первичного и ревизионного эндопротезирования коленного сустава развилось инфекционное воспаление. Происходило это в разные сроки, у 18 пациентов (40,1%) в раннем послеоперационном периоде, а у 26 (59,1%) в отдаленном, но так или иначе, купировать воспаление и сохранить эндопротез удалось только у 10 (22,7%) больных. В подавляющем большинстве случаев потребовалось провести двухэтапное хирургическое лечение, которое позволило купировать гнойный процесс в 89,3% случаев. Артродез был выполнен у 4 (9,1%) больных [5; 8].
Инфицирование может происходить через прямую или гематогенную передачу бактериальной флоры. Некоторыми примерами прямой передачи являются: несоблюдение условий стерильности в операционных, передача от инфицированного пациента, небрежность хирургов и обслуживающего персонала. Гематогенное инфицирование наблюдается после эпизода бактериемии. Например, стрептококковая инфекция может развиться после стоматологического вмешательства, стафилококковая – как следствие кожного инфекционного заболевания, энтерококковая и анаэробные инфекции – в результате желудочно-кишечных инфекционных заболеваний и инфекций мочеполовой системы [9].
Отек, боль и дисфункция коленного сустава возникают после эндопротезирования коленного сустава и усиливаются по мере прогрессирования инфекции. На фоне инфекции происходит перипротезный остеолиз, приводящий к нестабильности эндопротеза. У пациентов, не получающих своевременного лечения, может развиться сепсис и опасный для жизни септический шок [10].
На основе метаанализа, проведенного Cancienne J.M. с соавт., описаны исходы лечения 18 533 пациентов с ранними инфекционными осложнениями (в течение 1 года) после тотального эндопротезирования коленного сустава [11]. Среди них:
— 691 пациент (3,7%) умер в стационаре;
— 574 пациентам (3,1%) потребовалась ампутация конечности;
— 852 пациента (4,5%) перенесли артродез коленного сустава;
— 2683 пациентам (14,5%) проведена вторичная хирургическая обработка, без реимплантации;
— 13743 (74,1%) пациента прошли через двухэтапное реэндопротезирование коленного сустава, из них 11420 пациентам (61,6%) в течение 1 года проведено удаление спейсера и реимплантация, а 2323 пациентам (12,5%) оставлен спейсер.
Nodzo S.R. и соавторы, при проведении двухэтапного реэндопротезирования, разделили пациентов на три группы в зависимости от типа используемого спейсера [12]. В первой группе использовались преформованные артикулирующие спейсеры, во второй – спейсеры из цемента изготавливались интраоперационно. В третьей группе – в качестве спейсера использовали автоклавированный бедренный компонент удаленного эндопротеза. Признаки санации инфекционного процесса отметили в первой группе пациентов в 82,7% случаях, во второй группе – в 88,4%. Наименьшее количество положительных результатов отмечено в третьей группе – 79,4%. Таким образом, использование цементных спейсеров, изготовленных интраоперационно с использованием антибиотика по чувствительности флоры, приносит максимально положительный результат.
Цель исследования: провести анализ частоты, структуры и причин возникновения инфекционных осложнений при тотальном эндопротезировании и реэндопротезировании коленного сустава и определить оптимальную тактику лечения при этих осложнениях.
Материал и методы. В Новосибирском НИИТО за период с 2007 по 2016 год было проведено 12 245 операций первичного эндопротезирования коленного сустава. Инфекционные осложнения возникли у 470 (3,84%) человек. При этом эпифасциальная (поверхностная) инфекция была зафиксирована у 252 (2,06%) пациентов. В эту группу включены пациенты с некрозом послеоперационного шва и подкожной клетчатки, лигатурными свищами. В случае распространения процесса в пределах 5-6 см по ходу операционного шва, пациентам проводилась одномоментная санация и ушивание кожного дефекта. В случаях распространения процесса на весь шов, пациентам проводились этапные санационные перевязки до очищения стенок раны с последующим вторичным швом раны. Как результат применения такой методики лечения, у всех пациентов отмечался положительный результат.
Группу пациентов с субфасциальной (глубокой) инфекцией, развившейся в разные сроки, составили 218 пациентов (1,8%), что соответствует мировым тенденциям. По нашим убеждениям, в случае глубокой парапротезной инфекции, на фоне сформированной биопленки, эндопротез сохранять бесполезно, и он подлежит удалению. Однако дальнейшая тактика зависит от патологической флоры и других факторов. После удаления выполняется либо одномоментная имплантация нового эндопротеза, либо проведение этапного лечения с целью санации и последующего реэндопротезирования. В случае невозможности выполнения последующего этапа реэндопротезирования, в рассматриваемых случаях выполнялся артродез коленного сустава.
Бактериальное исследование пациентов с глубокой парапротезной инфекцией дало следующие результаты:
· у 172 (78,9%) пациентов была выделена грамположительная кокковая флора: у 113 пациентов – MSSA, у 33 – MSSE, у 8 пациентов – MRSA, и у 18 пациентов – MRSE;
· грамотрицательные палочки (Klebsiella, Pseudomonas, E.coli) были выделены у 33 пациентов (15,1%);
· грамположительные палочки (Korinebacterium, Propionobacter) – у 2 пациентов (0,9%);
· у 11 пациентов (5,0%) была выявлена смешанная флора.
При выборе тактики хирургического лечения больных с глубокой парапротезной инфекцией анализировались сроки возникновения инфекции, степень стабильности компонентов эндопротеза и степень вирулентности возбудителя. Также немаловажную роль в выборе тактики оперативного лечения играли сопутствующая патология и желания самого пациента.
Одномоментное реэндопротезирование после удаления эндопротеза выполнялось пациентам без выраженной сопутствующей патологии, в раннем послеоперационном периоде (до 6 мес.), при отсутствии признаков нестабильности эндопротеза и в случае чувствительности флоры к возможному проведению антибиотикотерапии. В ходе данного вида оперативного лечения выполняли удаление эндопротеза, патологических грануляций мягких тканей и имплантировали новый эндопротез с добавлением в цемент антибактериальных препаратов, подобранных по чувствительности к флоре. В последующем проводили адресную антибиотикотерапию в течение 6 недель.
Этим способом были пролечены 28 пациентов. В 26 случаях инфекция была купирована. У двух пациентов наблюдался рецидив, потребовавший проведения двухэтапного ревизионного вмешательства. Таким образом, выживаемость имплантата составила 93%.
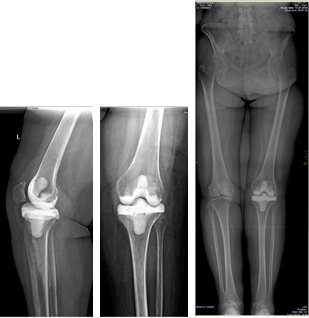
Клинический пример 1. Больная К., 62 года. Выполнено первичное эндопротезирование КС по поводу левостороннего гонартроза III ст.
Через 3 месяца после проведения оперативного лечения развилось осложнение в виде глубокой парапротезной инфекции. По результатам бактериологического исследования выявлен патогенный микроорганизм – MSSA. Больной выполнено удаление эндопротеза и одномоментное реэндопротезирование коленного сустава.
На контрольных осмотрах через 1 год, 3 и 5 лет признаков рецидива инфекции не было.
Двухэтапное ревизионное протезирование коленного сустава это наиболее распространенный способ оперативного лечения при парапротезной инфекции. Метод подразумевает дополнительный этап имплантации цементного спейсера с целью обеспечения «хирургической паузы» для санации полости сустава. Такой вид лечения применялся у большинства пациентов с глубокой инфекцией в различные сроки развития осложнений, при наличии возможности подбора антибиотика и отсутствии выраженной сопутствующей патологии.
В зависимости от степени сохранности связочного аппарата устанавливался артикулирующий либо неартикулирующий спейсер с добавлением антибиотика по чувствительности бактериальной флоры. После первого этапа пациенты получали антибиотикотерапию в течение 6-8 недель. Второй этап лечения – удаление цементного спейсера и реэндопротезирование коленного сустава, проводился по истечении 3-8 месяцев при условии нормализации клинических анализов и отсутствии положительных бактериологических исследований пунктата синовиальной жидкости.
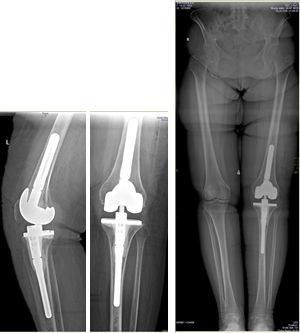
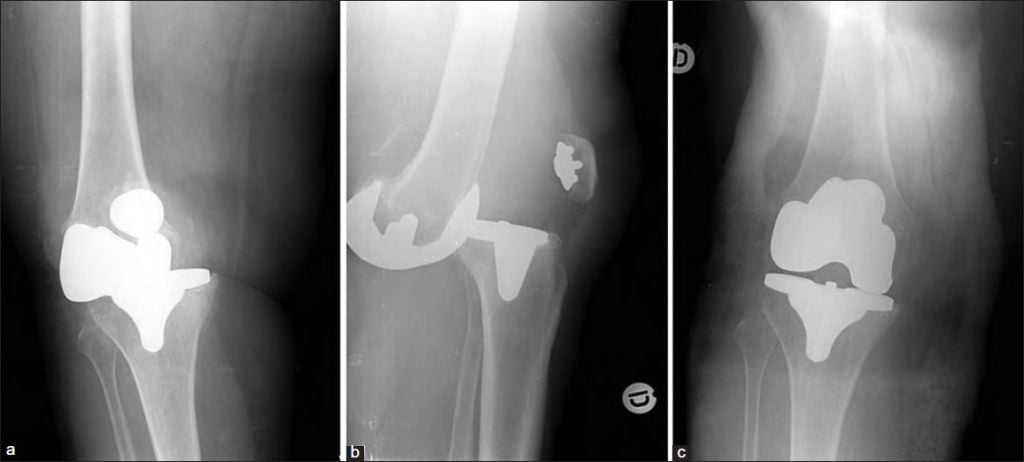
Клинический пример 2. Больная Г., 62 года. Первичное эндопротезирование коленного сустава было проведено по поводу гонартроза III ст. Через 3 года после проведенной операции перенесла рожистое воспаление голени, осложнившееся глубокой парапротезной инфекцией. По результатам бактериологического исследования был выявлен патогенный микроорганизм – MRSA. Больной было выполнено удаление эндопротеза, санация и имплантация цементного артикулирующего спейсера (рис. 1).
Рис. 1. Клинический пример 2. Рентгенограмма коленного сустава после
имплантации артикулирующего спейсера коленного сустава
Антибиотикотерапия поводилась в течение 6 недель. Через 6 месяцев, когда признаки инфекции были полностью купированы, больной выполнен второй этап оперативного лечения – удаление цементного спейсера и реэндопротезирование коленного сустава (рис. 2). На контрольных осмотрах через 1 и 3 года признаков рецидива инфекции не обнаружено.
Рис. 2. Клинический пример 2. Рентгенограмма коленного сустава
после удаления спейсера и реэндопротезирования коленного сустава
За период наблюдения двухэтапное оперативное лечение было проведено 146 пациентам. У 124 пациентов признаки инфекции были купированы. Процедив отмечен у 22 пациентов. С целью купирования инфекционного процесса этим больным выполнялся артродез коленного сустава в аппарате внешней фиксации.
Первично артродез коленного сустава выполнялся пациентам с вирулентной флорой, на поддающейся антибиотикотерапии, с выраженной сопутствующей патологией, позволяющей оперировать пациента только по жизненным показаниям, и в случае желания пациента.
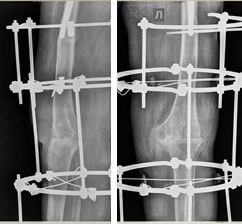
Клинический пример 3. Больная Л., 52 года. Первичное эндопротезирование коленного сустава было проведено по поводу вторичного артрозо-артрита коленного сустава III ст. на фоне ревматоидного полиартрита.
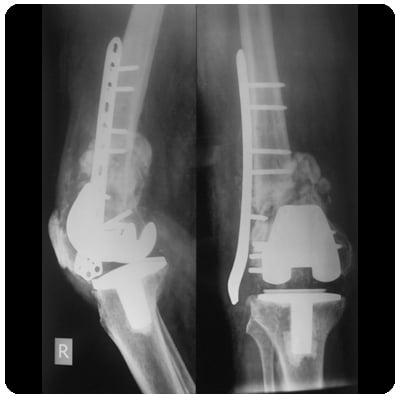
Через 6 месяцев после проведенного оперативного вмешательства у больной развилась глубокая парапротезная инфекция. Учитывая высокую активность основного заболевания, пациентка предпочла отказаться от дальнейших оперативных вмешательств, в связи с чем было выполнено удаление и артродез коленного сустава в аппарате внешней фиксации (рис. 3).
Рис. 3. Рентгенограмма коленного сустава после удаления эндопротеза и артродеза коленного сустава в аппарате внешней фиксации
По различным причинам артродез коленного сустава выполнялся в 66 случаях. В 54 случаях у пациентов сформировался костный анкилоз, и только в 12 случаях отмечалось формирование фиброзного анкилоза или неоартроза. Рецидива инфекции при выполнении артродеза коленного сустава зафиксировано не было.
Результаты. Таким образом, за 10 лет через отделение эндопротезирования коленного сустава Новосибирского НИИТО прошли 470 пациентов с парапротезной инфекцией. Эти пациенты получили следующее лечение:
— 252 (53,6%) пациентам с поверхностной инфекцией проведена вторичная хирургическая обработка, реимплантация эндопротеза не требовалась;
— 26 (5,5%) пациентам проведено одномоментное реэндопротезирование коленного сустава;
— 126 (26,8%) пациентов перенесли двухэтапное оперативное лечение;
— 66 (14,0%) пациентам по различным причинам выполнен артродез коленного сустава.
Ампутаций конечности и летальных исходов, вызванных инфекционным процессом, в отделении не отмечено.
Заключение. Инфекционные осложнения при первичном протезировании коленного сустава, невзирая на улучшение техники хирургического лечения и проводимой профилактики, остаются достаточно частыми и наиболее тяжелыми осложнениями. Как правило, они приводят к повторным оперативным вмешательствам, а зачастую и к инвалидизации пациентов. Обоснованный выбор хирургической тактики позволяет благополучно справиться с инфекционным осложнением и обеспечить пациенту приемлемое качество жизни.
Инфекция после протезирования коленного сустава
В нынешней медицинской деятельности эндопротезирование относится к перспективным методикам операционного излечения пациентов с дисфункцией опорно-двигательного аппарата любого происхождения. Но статистический прирост количества операций способствует увеличению числа пациентов с перипротезной инфекцией.
Диагностические тесты определяют частую задержку в выявлении инфекции протезированного сустава и, как следствие, позднее лечение.
Выбор конкретного метода лечения — хирургическая операция или этиотропная антибактериальная терапия — определяется состоянием пациента, коморбидной патологией, длительностью инфекционного процесса и крайней сложностью предстоящего оперативного лечения.
Зависимо от сроков протезирования выделяют раннюю, отсроченную и позднюю стадию ИПС. Возбудителями в большей степени отмечаются стафилококки (золотистый), грамотрицательные аэробы и анаэробы.
Ранние и отсроченные формы вызваны преимущественно стафилококками. А более поздние формы провоцированы другими микробами в результате гематогенной диссеминации.
К факторам риска ИПС относят:
1) Пожилой возраст, ожирение, диабет, артрит, онкология, иммунодефицитные состояния.
2) Двусторонняя артропластика, длительность операции более 2,5 часов, аутогемотрансфузия.
3) Некроз и расхождение краев раны, гематомы, инфекции мочевыводящих путей, несанированные очаги инфекции, ускоренное сокращение предсердий.
Начало заболевания может являться острым или субфебрильным. На ранней стадии присутствует лихорадка, болезненные ощущения, припухлости в области протеза (иногда со свищем и оттоком гнойного отделяемого). А на поздней стадии инфекции протезированного коленного сустава проявляется лишь периодический болевой синдром и отсутствие признаков системной болевой реакции.
В процессе сбора анамнеза у пациента уточняют о прошлых хирургических операциях на коленном суставе, а так же удостоверяются в наличии осуществленной антибактериальной терапии.
Рентгенография на начальном этапе инфекции мало информативна, но может быть полезна при диагностическом исследовании с другими заболеваниями суставов. УЗИ используют для дальнейшего патоморфологического и микробиологического исследования.
Как уже упоминалось ранее, лечение ИПС сочетает в себе хирургическое вмешательство и этиотропную антибактериальную терапию. Решение вопроса о сохранении эндопротеза или повторной установке — основа хирургической тактики.
В зависимости от данного решения выделяют разные категории операций: дебридмент с сохранением эндопротеза (обычно на ранней стадии), установка изготовленных индивидуально цементных спейсеров с антибиотиками, одно — или двухэтапное эндопротезирование и прочие вмешательства (например, ревизия с секвестрнекрэктомией и удалением эндопротеза).
В связи с рекомендациями специалистов профилактика проводится в обязательном порядке всем пациентам с суставными протезами, а так же для целого ряда прочих заболеваний. Следует отметить, что популярная в медицине ранее антибиотикопрофилактика при ИПС в настоящее время является малоэффективной, в качестве монотерапии.
О ревизионном эндопротезировании коленного сустава: показания, противопоказания, особенности проведения
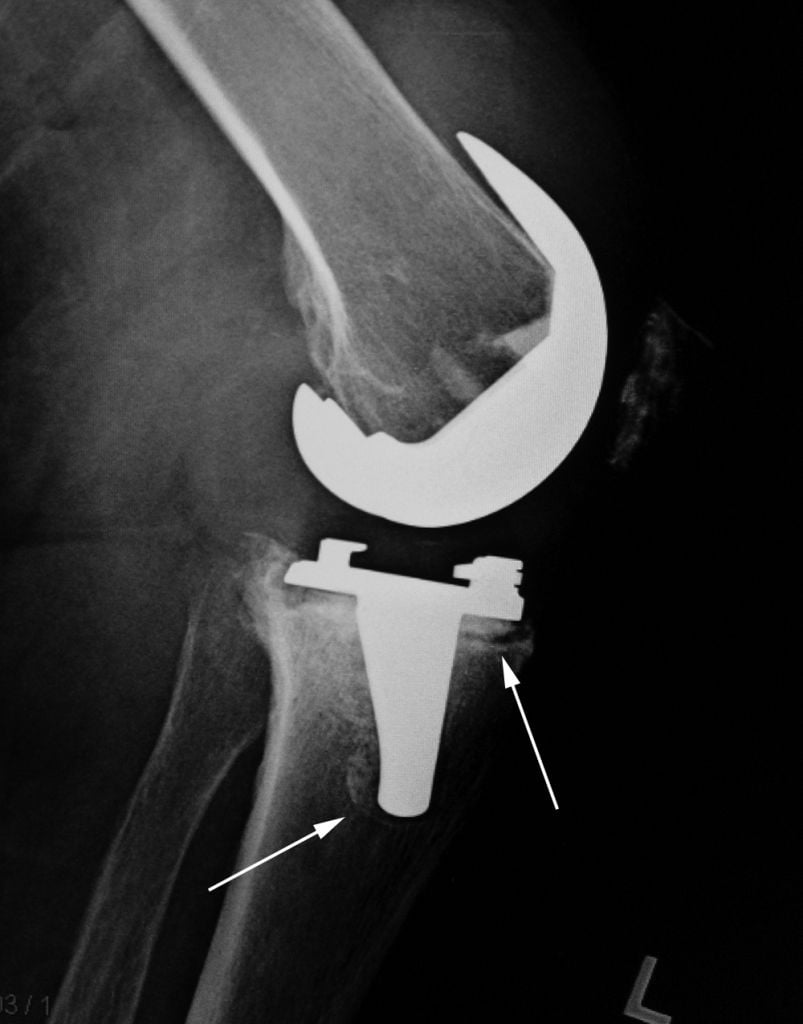
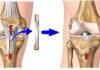
Ревизионное эндопротезирование — хирургическое вмешательство по удалению установленного эндопротеза коленного сустава и ставят на его место новый. Операцию делают из-за нестабильности импланта. Ревизионные вмешательства выполняют 8-10% пациентов после первичного.
Рентен после первичной операции. Имплант стоит корректно.
После установки онкологического эндопротеза в ревизионной операции нуждается около 30% пациентов. Органосохраняющее лечение опухолей чаще сопровождается осложнениями, чем обычная замена сустава.
Операция по ревизионной замене коленного сустава длится намного дольше, чем при обычной. Это повышает риск развития инфекционных, тромбоэмболических и других осложнений.
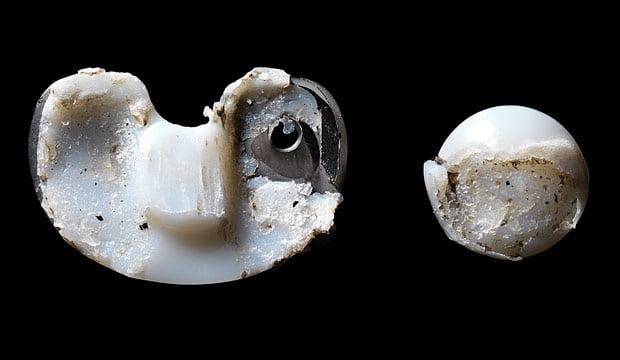
Извлеченный компонент эндопротеза по причине износа.
| Видео (кликните для воспроизведения). |
 |
История лечения: Как Дмитрий Николаев избавился от боли в суставах |
Цена повторной замены, то в случае асептической нестабильности она увеличивается на 25-100%, а при развитии перипротезной инфекции – в целых 3-4 раза. Цены на ревизионные эндопротезы также немного выше, чем на обычные.
В каких случаях нужна замена эндопротеза
Таблица 1. Наиболее частые осложнения, требующие замены эндопротеза.
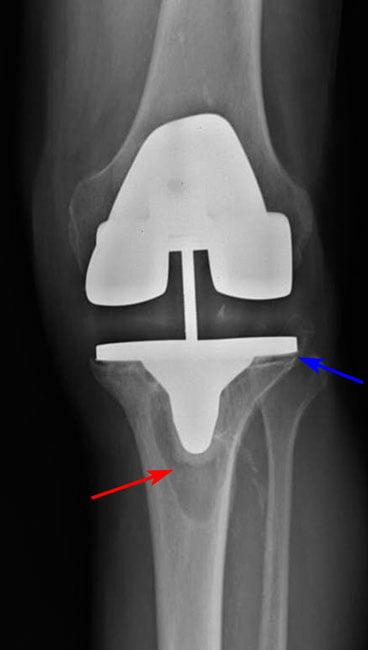
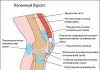
Рис 2. Остеолизис (красная стрелка) вокруг большеберцовой части приводит к ослаблению протеза (синяя стрелка).
Асептическое расшатывание
По данным разных авторов, осложнение является причиной 23-86% ревизионных хирургических вмешательств.
Асептическое расшатывание развивается вследствие остеолиза – невоспалительной резорбции костной ткани вблизи импланта. Причиной может быть системный остеопороз или сопряженное с возрастом нарушение метаболизма костей. Асептическая нестабильность возникает из-за неправильной имплантации компонентов эндопротеза.
На снимке еле видны зоны прорежения костной ткани.
- выбор неподходящего протеза;
- неправильный подбор размера, типа и способа фиксации импланта;
- технические ошибки во время самого хирургического вмешательства;
- неадекватная пространственная ориентация эндопротеза.
Асептическая нестабильность бывает ранней и поздней. Первая развивается на протяжении 5 лет после операции и обычно говорит об ошибках врачей. Вторая возникает в более поздние сроки, чаще вследствие резорбции костной ткани. Существует ряд препаратов, приём которых помогает избежать остеолиза.
Инфекция — отторжение
Для патологии характерно воспаление костной ткани вблизи протеза с последующим развитием септической нестабильности сустава. Осложнение занимает 2-е место среди всех причин ревизионных операций.
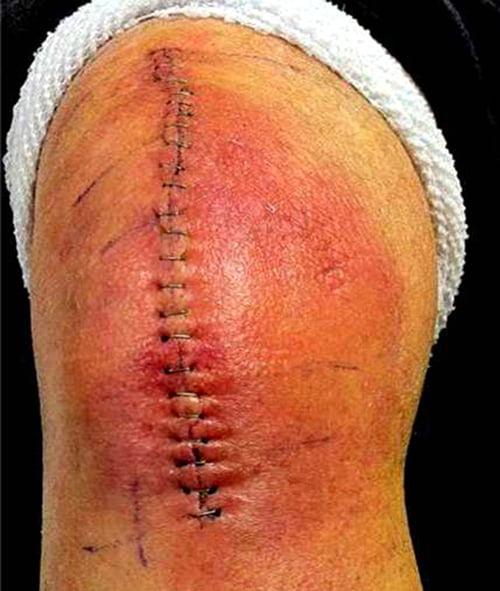
Красный и горячий шов это повод навестить врача.
Абсолютным показанием к повторной замене коленного сустава является только поздняя перипротезная инфекция, развивающаяся позднее 1 месяца после операции. Более ранние осложнения лечат консервативно или путем хирургического удаление некоторых компонентов протеза.
Ревизионное эндопротезирование чаще всего проводят в два этапа. На сегодня этот подход является «золотым стандартом» в лечении инфекционных осложнений. Выполнение одноэтапной реимплантации возможно лишь при низкой вирулентности возбудителя и отсутствии системных проявлений инфекции. При этом у пациента не должно быть свищей, массивных костных дефектов, несостоятельности мягких тканей или капсульно-связочных структур.
Повреждение импланта
Среди всех повреждений эндопротеза чаще всего встречается изнашивание тибиального полиэтиленовго вкладыша. Устранить проблему обычно удается открытым дебридментом. Суть операции заключается в артротомии, хирургической обработке суставной полости и замене вкладыша.
Результат травм или падений.
Ревизионное эндопротезирование необходимо делать в случае повторных вывихов, перелома одного или нескольких компонентов протеза.
Контрактуры или несостоятельность разгибательного аппарата
Показанием к ревизионной операции является нестабильность компонентов эндопротеза, возникшая из-за развития контрактур или несостоятельности разгибательного аппарата голени. Причиной может быть повреждение тканей в ходе операции или отсутствие реабилитации в восстановительном периоде.
Переломы костей вблизи импланта
Переломы костей редкое осложнение. Они возникают на фоне остеолиза или после установки онкологического эндопротеза. Повторная замена сустава при переломе является необходимой. Она должна быть выполнена в максимально краткие сроки.
Конструкция после перелома.
Местный рецидив новообразования
Повторное хирургическое вмешательство требуется людям ранее перенесшим онкологическое эндопротезирование коленного сустава. Помимо обычных осложнений (асептическое или септическое расшатывание, переломы и т.д.) показанием к ревизионной операции может быть рецидив, то есть повторное развитие, опухоли.
Противопоказания к ревизионному эндопротезированию
Все противопоказания к повторной операции делятся на абсолютные и относительные. При наличии первых выполнять хирургическое вмешательство запрещено, поскольку это может привести к тяжелым осложнениям.
- неспособность пациента самостоятельно передвигаться;
- гемипарез на стороне планируемого хирургического вмешательства;
- острый или обострившийся тромбофлебит;
- тяжелые хронические заболевания сердечно-сосудистой системы;
- дыхательная недостаточность 3 ст.;
- наличие несанированных очагов хронической инфекции в организме;
- выраженная остеопения;
- серьезные психические или нейромышечные расстройства;
- отсутствие костномозгового канала бедренной кости.
Среди относительных противопоказаний нужно выделить печеночную недостаточность, тяжелые хронические декомпенсированные заболевания, гормональную остеопатию и ВИЧ-ассоциированные иммунодефицитные состояния.
Обследование перед операцией
Перед повторной заменой сустава пациент должен пройти обследование. Помимо общеклинических исследований ему назначают рентгенографию коленного сустава в 2-х проекциях, КТ, МРТ, денситометрию и УЗДГ вен нижних конечностей. Больному также делают развернутую коагулограмму и ЭхоКГ.
Сдача анализов, инструментальные методы исследования и консультации узких специалистов помогают оценить общее состояние пациента и тактику ревизионного эндопротезирования. Это дает возможность избежать непредвиденных осложнений и сделать хирургическое вмешательство успешным.
При выполнении ревизионного эндопротезирования большое значение имеет правильность подбора импланта. Поэтому в больнице, где выполняется хирургическое вмешательство, должна быть в наличии полная линейка эндопротезов.
Вмешательство при нестабильности без потери костной массы
В этом случае устанавливают как первичный, так и ревизионный эндопротез (окончательное решение врачи принимают после оценки состояния коллатеральных связок коленного сустава). Небольшие дефекты заполняют цементом, костной алло- или аутокрошкой.
Операция при выраженной потери костной массы
При выраженной потере губчатой и кортикальной костной массы нельзя использовать стандартные модели протезов. Причина этого – отсутствие нужной опоры для импланта. Поэтому в данной ситуации больному выполняют костную аллопластику и устанавливают специальный шарнирный эндопротез.
Операция при инфекционном сложении
Хирургическое вмешательство чаще всего выполняют в два этапа, интервал между которыми может составлять от 3 до 6 месяцев. На первом этапе хирурги удаляют эндопротез и некротические массы, обрабатывают рану антисептиками и устанавливают цементный спейсер с антибиотиками широкого спектра действия. Только после исчезновения признаков инфекции больному устанавливают новый эндопротез.
Любопытно! Операционный доступ и техника послойного ушивания раны обычно отличаются в разных клиниках. В более «продвинутых» медицинских учреждениях чаще используют малоинвазивные техники, позволяющие выполнить хирургическое вмешательство с минимальным ущербом для пациента.
Реабилитация в послеоперационном периоде
В первые дни после операции больному проводят тщательную профилактику тромбоэмболических осложнений. С этой целью ему бинтуют ноги эластичными бинтами или чулками. Вместе с этим больному подбирают комплекс упражнений, позволяющий восстановить нормальную подвижность сустава. Отметим, что в первые дни медперсонал практически учит человека двигаться, ходить, подниматься по лестнице.
Первое время шов надежно прячется.
В более позднем восстановительном периоде пациенту нужна лечебная гимнастика, физиотерапия и некоторые другие реабилитационные мероприятия. Именно они помогают восстановить функциональную активность колена и вернуть больного к полноценной жизни. Отсутствие полноценной реабилитации повышает риск развития осложнений и нередко приводит к неудовлетворительным результатам ревизионного эндопротезирования.
Хирургическое лечение параэндопротезной инфекции коленного сустава
Врачебные действия зависят от тяжести поражения, от самочувствия больного и его физического состояния. В случае, если консервативная концепция лечения параэндопротезной инфекции терпит неудачу или если непосредственно существует обширный инфекционный процесс, то остается хирургический вариант сохранения протеза. Таких методик несколько:
- Оперативная ревизия с сохранением эндопротеза.
- Открытая ревизия и установка ревизионного протеза.
- Другие процедуры (артродез).
В некоторых ситуациях приходится прибегать к терапии отчаяния – ампутации конечности.
Оперативная ревизия с дебридментом
Оперативная ревизия с дебридментом (удалением омертвевших/ некротизированных тканей), синовэктомией, промыванием и дренированием осуществляется посредством открытой хирургии или, первоначально, артроскопической операции. Таким образом пытаются сохранить протез при соблюдении следующих условий:
- речь идет о ранней инфекции (менее 6 недель после имплантации протеза);
- еще нет образования свища;
- нет подтверждения (клинического и рентгенологического) ослабления протеза;
- стабильная фиксация компонентов эндопротеза;
На результаты такой терапии оказывают положительное влияние следующие факторы:
- были обнаружены грамположительные возбудители, которые являются чувствительными к различным антибиотикам;
- речь идет о молодых, здоровых пациентах (т.к., возможно, будет необходимым неоднократное выполнение ревизий);
На результаты такой терапии оказывают отрицательное влияние следующие факторы:
- подтверждение образования свища;
- связанные эндопротезы;
- иммунокомпрометированные пациенты;
Если эти факторы учитываются при планировании лечения, то попытка сохранить протез с использованием этого метода терапии, может быть хорошей альтернативой ревизионному протезированию.
Использование промывочно — отсасывающих дренажей является не бесспорным, так как уже через два дня развиваются, так называемые, «пути промывки» и, таким образом, большие области суставов больше не могут быть достигнуты.
В том случае, если есть резистограмма, то во время операции и после нее первоначально вводят внутривенно антибиотик, соответствующий результатам резистограммы. По прошествии шести дней антибиотик вводится орально. Лечение антибиотиком следует поддерживать в течение минимум шести недель. Возможное преобразование в соответствии с резистограммой является обязательным. Контроль параметров инфекции, следует проводить с помощью лабораторных исследований, сначала с интервалом в один день, а затем (в амбулаторных условиях) регулярно один раз в неделю ежемесячно в течение года, затем по показаниям. Если удаление протеза становится неизбежным, то кроме обязательной процедуры удаления омертвевших тканей (дебридмента), должны быть удалены все без исключения части цемента.
Открытая ревизия и установка ревизионного протеза
Открытая санация с дебридментом, синовэктомией, промыванием антисептиками и дренированием с последующим реэндопротезированием показана при:
- нестабильности компонентов протеза;
- чувствительной к антибиотикотерапии микрофлоре;
Через четыре-шесть недель и, как правило, по крайней мере после трех отрицательных результатов бактериологических исследований, можно имплантировать ревизионный протез.
Ревизионные протезы обычно представляют собой модель для поверхностной замены, ротационный или шарнирный протез с осевой стабилизацией.
При хронических инфекциях, методом выбора терапии продолжает оставаться замена протеза в два этапа. С помощью этого метода удается добиться как высокой эффективности при санациии инфекции, так и хороших функциональных результатов. С другой стороны, этот метод создает значительно бо́льшую нагрузку на пациента, поскольку необходимо выполнение, как минимум, двух хирургических вмешательств. Вследствие этого, двухэтапная замена протеза является более трудоемким и, следовательно, более дорогостоящим методом, чем одноэтапная операция по замене протеза.
Одноэтапная операция по замене протеза в течение некоторого времени была методом второго выбора. Она может использоваться преимущественно у пациентов более пожилого и даже старческого возраста или мультиморбидных больных, а также, на ранних стадиях поверхностных и, следовательно, не костных инфекций. Одним из недостатков одноэтапного метода по замене протеза являются более высокие показатели реинфекции (повторного заражения).
При хронических инфекциях, в результате которых иногда образуются большие дефекты мягких тканей часто с обнажением частей протеза, используются пластические хирургические процедуры. Это включает в себя трансплантаты расщеплённого лоскута, фасциальнокожные лоскуты, локальные мышечные ротационные лоскуты и свободные мышечные лоскуты.
Открытая ревизия и использование спейсеров
При замене протеза в два этапа и при подготовке к выполнению артродеза часто применяется техника с использованием спейсера. Результаты исследований показывают, что наименьшая потеря костной массы ожидается при использовании статического спейсера соответствующего размера и толщины и с интрамедуллярной фиксацией. В этих условиях, использование техники лечения с применением спейсера на коленном суставе, является хорошим методом терапии инфекций с высокими показателями успеха в рамках проведения двухэтапной операции по замене протеза или для выполнения артродеза. При этом, наблюдается тенденция к отказу от использования больших массивных спейсеров и переход к применению альтернативных вариантов.
Существуют различные возможности временной имплантации заполнителей. Спейсер позволяет долго поддерживать необходимую концентрацию антибиотиков в воспалительном очаге. Спейсеры имеют свои преимущества и недостатки. Во-первых, это лучшая мобильность пациентов и, следовательно, связанный с этим, больший комфорт. Это лучшее заживление мягких тканей и улучшении качества кости, так необходимое для реимплантации протеза. Также, следует учитывать выигрыш во времени (8-10 недель), в течение которого хирург может рассмотреть все хирургические и терапевтические варианты до тех пор, пока не будет выполнена реимплантация протеза. Использование спейсеров в рамках двухэтапной реимплантации протеза или для подготовки артродеза, является хорошим методом санации инфекций с высокими показателями успеха.
В настоящее время, с большей степенью осторожности используются массивные спейсеры костного цемента из полиметилметакрила (PMMA) с добавленными антибиотиками. В качестве альтернативы можно использовать заполнитель с осевой стабилизацией с добавками антибиотиков или с включёнными (карбоновымии) стержнями. Кроме того, возможно вложение антибиотикосодержащих цепей полиметилметакрила (PMMA). Мониторинг инфекции осуществляется так же, как было описано выше.
Если эта мера также оказывается недостаточной, то в качестве еще одной возможности остается выполнение артродеза. Это является возможным в случае доказанного отсутствия инфекции, однако, в некоторых случаях выполняется, также, в качестве септического артродеза.
После артродеза происходит полное обездвиживание сустава. Это вмешательство применяется в крайних ситуациях, когда исчерпаны все возможности для сохранения эндопротеза.
Показания:
- неэффективность этапного лечения;
- большие дефекты мягких тканей и костей;
- молодой возраст;
- нецелесообразность ревизионного протезирования;
- тяжелые сопутствующие болезни;
- трудности с разгибанием коленного сустава;
- сепсис;
Плюсы:
- процент успешной санации достаточно высокий;
- неплохие функциональные результаты;
Недостатки:
- большая часть пациентов с артродезом нуждается в постоянном использовании вспомогательных средств для ходьбы из-за укорочения ноги;
- повышенная нагрузка смежных сочленений прооперированной ноги и суставов здоровой, нижних отделов позвоночника;
У пациентов с большими дефектами мягких тканей и костей, выполнение артродеза коленного сустава является рекомендуемым решением с высокими процентами случаев успешной санациии и приемлемыми функциональными результатами. Выполнение артродеза приводит к значительному улучшению качества жизни после удаления инфицированного эндопротеза коленного сустава. Тем не менее, главным недостатком данного метода является то, что многие пациенты после выполнения операции нуждаются в вспомогательных средствах для ходьбы. Согласно ряду исследований, самые лучшие функциональные результаты и самые высокие показатели успеха при санациии инфекции, были выявлены при выполнении артродеза с помощью интрамедуллярного титанового модульного стержня.
При отрицательных признаках инфекции в настоящее время предпочтение отдается внутренней стабилизации, например, с помощью артродезного гвоздя, связанных стержней или (двойного) пластинчатого остеосинтеза. Внешний фиксатор остается противопоказанным при инфекционном артродезе, а кольцевые и гибридные системы в значительной степени заменяют классический каркас Чарнли (Charnley). Согласно результатам, указанным в медицинской литературе, частота применения артродезов составляет 43%, а показатель успеха — 81%.
Высокие показатели успеха были достигнуты в отношении устранения инфекций. Таким образом, можно было контролировать смешанные инфекции и такие, при которых существуют высоковирулентные возбудители инфекций. В рамках различных доступных методов лечения, при артродезах с фиксацией гвоздем наблюдались самые низкие показатели реинфекции с хорошими функциональными результатами, при условии соблюдения индикации для диапазона сгибания. Более подробно об артродезе – здесь
Ампутация бедра
По окончании всех возможных терапевтических процедур, когда заменa протезa, дебридемент (удаление омертвевших омертвевших/некротизированных тканей) или выполнение артродеза с соответствующей сопутствующей терапией не привели к желанному избавлению от инфекции, предпринимается ампутация бедра. Цель ампутации заключается в том, чтобы защитить пациента от опасных для жизни осложнений, например, посредством системного, септического рассеивания возбудителей инфекции (принцип “жизнь перед конечностью»).
Факторами риска для возникновения персистирующей инфекции, а точнее, факторами, повышающими вероятность ампутации бедра, являются:
- грамотрицательные или смешанные инфекции;
- первичный хронический полиартрит, при котором пациентам во время имплантации протеза приходится регулярно принимать кортикостероиды;
- многочисленные предоперационные операции на колене;
- тромбоз артерий ног;
- курение табака;
Ампутация является средством выбора при резистентных к терапии инфекциях, которые преимущественно поддерживаются высоковирулентными бактериями и при осложнениях, связанных с угрожающим жизни септическим распространением инфекции. В последние десятилетия частота ампутаций после имплантации протезов коленного сустава была еще выше, чем в настоящее время. Несмотря на плохие клинические результаты, ампутация бедра по-прежнему остается последней мерой при лечении резистентных к терапии инфекций, которые часто поддерживаются высоковирулентными бактериями (резистентным к метициллину золотистым стафилококком = MRSA, резистентным к ванкомицину золотистым стафилококком = VRSA или, например, синегнойной палочкой [Pseudomonas aeruginosa]). Другой индикацией является предоперационное или интраоперационное повреждение сосудов, при котором не может быть обеспечена своевременная и достаточная реперфузия (восстановление кровотока) конечности.
Принимая во внимание факторы риска и при условии, что больше нельзя откладывать неизбежную ампутацию, в большинстве случаев должно быть возможным предотвратить опасные для жизни септические осложнения и получить пригодную к протезированию культю, сохраняя, таким образом, пациенту возможность ходить. При выработке тактики операции учитывается время, которое прошло после последнего вмешательства, количество проведенных ревизионных вмешательств, количество дебридментов (процедур удаления омертвевших/некротизированных тканей), промываний/ дренирований и синовэктомий, затем планируется длина культи и возможность использования протеза.
Заключение.
Лечение инфицированного протеза коленного сустава является комплексным и требующим больших затрат и времени. Оно предъявляет высокие требования к пациентам и к лечащим врачам. Чтобы минимизировать риск развития инфекции протеза, еще при подготовке к операции следует принимать во внимание известные факторы риска и стремиться их оптимизировать.
| Видео (кликните для воспроизведения). |
|
Доктор С.М.Бубновcкий подтверждает силу препарата... Читать далее >>> |
Современные технологии позволяют не только сохранить эндопротез при инфекционном процессе, но и производить этапные реконструктивные вмешательства с параллельным лечением инфекции. Для получения хороших результатов надо обращаться в специализированные ортопедические клиники, которые имеют в штате опытных квалифицированных специалистов, новое оборудование и качественный инструментарий. В этом случае, после успешной ревизионной операции и качественного реабилитационного периода, имея сильную мотивацию и желание, можно вернуться в жизнь со спортом и активными выходными.
Источники
-
Алешина, О. Болезни ног. Варикоз, артрит, подагра. Лечение и профилактика / О. Алешина. — M. : Контэнт, 2013. — 208 c. -
Новосельцев, С. В. Основы консервативного лечения пациентов с грыжами поясничных межпозвонковых дисков / С. В. Новосельцев. — М. : Фолиант, 2011. — 551 c. -
Бобрович, П. В. Лечимся дома. Артрит / П. В. Бобрович. — М. : Попурри, 2010. — 208 c. - Кирпичникова, М. П. Биосовместимые материалы / Под редакцией В. И. Севастьянова, М. П. Кирпичникова. — М. : Медицинское информационное агентство, 2011. — 560 c.
- Родионова, О. Н. Артрит. Лучшие методы восстановления и профилактики: моногр. / О. Н. Родионова. — М. : Вектор, 2013. — 160 c.