Содержание
- 1 ❝ Реконструктивное эндопротезирование при замещении пострезекционных дефектов костей коленного сустава ❞
- 2 Эндопротезирование и реконструктивно восстановительные операции на суставах
- 3 ❝ Реконструктивное эндопротезирование при замещении пострезекционных дефектов костей коленного сустава ❞
- 4 ВОССТАНОВИТЕЛЬНАЯ ХИРУРГИЯ
- 5 Операции на суставах
- 6 Лечебно-диагностические центры
- 7 РАННЕЕ ВОССТАНОВИТЕЛЬНОЕ ЛЕЧЕНИЕ БОЛЬНЫХ ПОСЛЕ РЕКОНСТРУКТИВНО-ПЛАСТИЧЕСКИХ ОПЕРАЦИЙ НА ТАЗОБЕДРЕННОМ СУСТАВЕ
❝ Реконструктивное эндопротезирование при замещении пострезекционных дефектов костей коленного сустава ❞
С начала 70-х годов реконструктивное эндопротезирование благодаря использованию новых технологий стало методом выбора органосберегающей хирургии при резекции суставных концов длинных костей по поводу их опухолевого поражения (прежде всего злокачественного).
Полноценное предоперационное обследование, включающее компьютерную томографию, магнитно-резонансное исследование, сцинтиграфию скелета и (при необходимости) ангиографию, позволяет точно определить стадию процесса и безопасные границы резекции. При условии адекватной резекции длительность безрецидивного периода и общая выживаемость сходны с таковыми при ампутации (9,11). Преимуществом эндопротезирования в отличие от других методов реконструкции является возможность одномоментной компенсации массивных костных дефектов при сохранении движений в суставе. Это обеспечивает хорошее восстановление функции и более высокий уровень качества жизни больного (1—3,5,7), Кроме того, наличие имплантата не служит противопоказанием для проведения (продолжения) химиолучевой терапии, в чем нуждаются большинство больных со злокачественными опухолями костей. В случае использования других методов замещения пострезекционных дефектов (ауто- и аллопластики) химиолучевое лечение может отрицательно сказаться на судьбе трансплантатов и восстановлении функции конечности.
Однако в 25% случаев при замещении пострезекционных дефектов длинных костей в среднем через 3—4 года возникает необходимость в ревизионной операции. Почти в половине случаев (44— 47%) ее причиной является механическая нестабильность имплантата (1,6—12). По нашим данным, асептическая нестабильность (АН) онкологических эндопротезов после удаления злокачественных опухолей возникает наиболее часто и в более ранние сроки при замещении пострезекционных дефектов проксимального суставного конца большеберцовой кости (соответственно в 31% случаев; через 2,0 ±1,1 года), а также дистального суставного конца бедренной кости (27,3%; через 5,5±3,7 года). По сравнению с традиционным ортопедическим эндопротезированием тазобедренного сустава эти показатели хуже; данный факт особенно актуален, так как применение современных методик химиолучевой терапии позволяет добиться продолжительных сроков выживания даже при высокозлокачественных опухолях.
Анализ показал, что частота развития АН массивных эндопротезов коленного сустава зависит от локализации замещаемого дефекта, его протяженности, возраста пациентов (7,11). К факторам, способствующим асептическому расшатыванию компонентов эндопротеза и даже его перелому, относятся высокий рост и большая масса тела больных, повышенная активность молодых пациентов (8).
Есть мнение, что расшатывание онкологических эндопротезов связано с влиянием частиц полиэтилена при его износе и аналогично таковому при традиционном эндопротезировании тазобедренного сустава (13). Однако частота АН онкологических эндопротезов коленного сустава выше, чем протезов тазобедренного сустава, и расшатывание развивается до существенного износа полиэтилена. К тому же гистологические исследования ткани на границе кость—имплантат вокруг онкологических эндопротезов не выявили наличия продуктов износа полиэтилена. Считается, что расшатывание массивных эндопротезов связано с механической причиной: подвижностью на границе кость — имплантат.
Для эндопротеза тазобедренного сустава Сиваша К.Шерепо выделил 2 типа АН: 1) механическая, обусловленная интенсивностью и длительностью пускового фактора (когда нагрузка превышает адаптационные механизмы, возможности физиологической и репаративной регенерации); возникает в сроки до 3 лет после операции; 2) металлозная, связанная с взаимодействием окружающей имплантат ткани и продуктами износа; возникает через 7 и более лет после операции. Автор отмечает, что с 1-м типом АН можно бороться консервативно, т.е. изменить условия работы, уменьшить нагрузку на конечность. В лечении 2-го типа АН чаще показано реэндопротезиро . читать далее
Эндопротезирование и реконструктивно восстановительные операции на суставах
Особенности процедуры эндопротезирования суставов
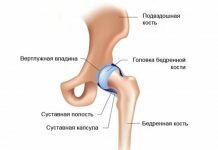
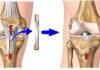
Эндопротезирование суставов является наиболее прогрессивным хирургическим методом лечения и полного восстановления суставов. Во время операции хирург производит замену поврежденного в результате травмы либо болезни сустава на искусственный аналог.
Замена сустава на искусственный аналог
Имплантат сустава рассчитан на серьезную нагрузку в процессе обычной ходьбы, бега, других видов физической активности. Он полностью заменяет здоровый сустав, выполняет все его функции. С его помощью выполняется разгибание и сгибание, приведение и отведение, внутренняя и наружная ротация. В результате, в прооперированном суставе улучшается подвижность, а болезненные ощущения полностью исчезают или существенно ослабевают. Большое значение для восстановления здоровья имеет реабилитация после эндопротезирования тазобедренного сустава.
Есть ряд противопоказаний, наличие которых не позволяет сделать операцию. К числу основных относятся:
- Наличие заболеваний сердечно-сосудистой системы (стадия декомпенсации).
- Печеночно-почечная недостаточность.
- Полиаллергия.
- Гемипарез.
- Остеопения.
- Декомпенсированные заболевания дыхательных органов.
- Гнойная инфекция, перенесенный сепсис.
- Отсутствие костномозгового канала кости бедра.
При назначении операции доктор оценивает состояние каждого пациента индивидуально, учитывая актуальное состояние его здоровья и динамику протекания заболевания.
Перед проведением операции проводится консультация, в процессе которой доктор производит необходимые исследования, устанавливает степень повреждения сустава, подбирает оптимальный тип протеза.
Следующим этапом является подготовка к операции. Длится она 1-2 дня. В этот период пациент госпитализируется и проходит полное обследование.

Непосредственно операция длится 1.5-3 часа. Она считается достаточно сложной, поэтому от хирурга требуется наличие соответствующей квалификации и компетентности. После проведения операции пациенту показан прием обезболивающих препаратов и антибиотиков.
Когда назначается эндопротезирование тазобедренного сустава?
Эндопротезирование тазобедренного сустава – это радикальный способ лечения. Медики прибегают к нему при наличии у пациентов следующих травм и заболеваний:
- болезнь Бехтерева (анкилозирующий спондилит), приводящая к анкилозу сустава;
- асептический некроз головки бедра;
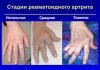
- дегенеративно-дистрофические болезни, к которым относятся артрозы, артриты;
- красная волчанка;
- переломы либо ложные суставы бедренной кости;
- ревматоидный полиартрит;
- переломы бедра у пожилых людей, возраст которых достиг 65 лет;
- опухоль шейки бедра либо головки бедренной кости.
Ключевое значение для принятия решения о проведении эндопротезирования тазобедренного сустава имеют:
- стадия заболевания;
- степень выраженности функциональных нарушений деятельности конечностей;
- выраженность и интенсивность болевого синдрома;
- уровень снижения физической активности пациента из-за болезни;
- эффективность физиотерапевтического, а также медикаментозного лечения;
- отсутствие перспектив выздоровления при помощи других методов лечения.
Первые сутки после операции разрешается активизация только в постели. На следующий день уже можно садиться, делать упражнения для мышц (статичные). На третьи сутки можно начинать ходить с костылями. Через 10-12 дней, если все в норме, снимают швы.
Для пациентов, переживших эндопротезирование тазобедренного сустава реабилитация важна не меньше, чем профессионализм хирурга. Им нужно регулярно выполнять специальную лечебную физкультуру. Необходима она для овладения навыками правильно двигаться, укрепления мышц, предотвращения контрактур.
После выписки, которая осуществляется через 10-12 дней, пациент может проходить реабилитационный процесс дома, следуя рекомендациям доктора. Другой вариант – посещать занятия ЛФК либо отправиться в специальный реабилитационный центр. Последний способ восстановления является более желаемым, поскольку в центре за процессом восстановления наблюдают опытные врачи-реабилитологи.
В любом случае на протяжении 6-8 недель пациенту следует избегать чрезмерных нагрузок на ногу, не перегружать ее чрезмерной амплитудой движений. Запрещено скрещивать ноги.

Через несколько месяцев после эндопротезирования тазобедренного сустава люди возвращаются к полноценной жизни. В дальнейшем они даже могут заниматься спортом.
При соблюдении рекомендаций доктора срок службы эндопротеза достигает 15-20 лет.

Автор статьи: Василий Шевченко
Позвольте представиться. Меня зовут Василий. Я уже более 8 лет работаю массажистом и костоправом. Я считаю, что являюсь профессионалом в своей области и хочу помочь всем посетителям сайта решать свои задачи. Все данные для сайта собраны и тщательно переработаны с целью донести в доступном виде всю требуемую информацию. Перед применением описанного на сайте всегда необходима ОБЯЗАТЕЛЬНАЯ консультация с вашим специалистом.
❝ Реконструктивное эндопротезирование при замещении пострезекционных дефектов костей коленного сустава ❞
С начала 70-х годов реконструктивное эндопротезирование благодаря использованию новых технологий стало методом выбора органосберегающей хирургии при резекции суставных концов длинных костей по поводу их опухолевого поражения (прежде всего злокачественного).
Полноценное предоперационное обследование, включающее компьютерную томографию, магнитно-резонансное исследование, сцинтиграфию скелета и (при необходимости) ангиографию, позволяет точно определить стадию процесса и безопасные границы резекции. При условии адекватной резекции длительность безрецидивного периода и общая выживаемость сходны с таковыми при ампутации (9,11). Преимуществом эндопротезирования в отличие от других методов реконструкции является возможность одномоментной компенсации массивных костных дефектов при сохранении движений в суставе. Это обеспечивает хорошее восстановление функции и более высокий уровень качества жизни больного (1—3,5,7), Кроме того, наличие имплантата не служит противопоказанием для проведения (продолжения) химиолучевой терапии, в чем нуждаются большинство больных со злокачественными опухолями костей. В случае использования других методов замещения пострезекционных дефектов (ауто- и аллопластики) химиолучевое лечение может отрицательно сказаться на судьбе трансплантатов и восстановлении функции конечности.
Однако в 25% случаев при замещении пострезекционных дефектов длинных костей в среднем через 3—4 года возникает необходимость в ревизионной операции. Почти в половине случаев (44— 47%) ее причиной является механическая нестабильность имплантата (1,6—12). По нашим данным, асептическая нестабильность (АН) онкологических эндопротезов после удаления злокачественных опухолей возникает наиболее часто и в более ранние сроки при замещении пострезекционных дефектов проксимального суставного конца большеберцовой кости (соответственно в 31% случаев; через 2,0 ±1,1 года), а также дистального суставного конца бедренной кости (27,3%; через 5,5±3,7 года). По сравнению с традиционным ортопедическим эндопротезированием тазобедренного сустава эти показатели хуже; данный факт особенно актуален, так как применение современных методик химиолучевой терапии позволяет добиться продолжительных сроков выживания даже при высокозлокачественных опухолях.
Анализ показал, что частота развития АН массивных эндопротезов коленного сустава зависит от локализации замещаемого дефекта, его протяженности, возраста пациентов (7,11). К факторам, способствующим асептическому расшатыванию компонентов эндопротеза и даже его перелому, относятся высокий рост и большая масса тела больных, повышенная активность молодых пациентов (8).
Есть мнение, что расшатывание онкологических эндопротезов связано с влиянием частиц полиэтилена при его износе и аналогично таковому при традиционном эндопротезировании тазобедренного сустава (13). Однако частота АН онкологических эндопротезов коленного сустава выше, чем протезов тазобедренного сустава, и расшатывание развивается до существенного износа полиэтилена. К тому же гистологические исследования ткани на границе кость—имплантат вокруг онкологических эндопротезов не выявили наличия продуктов износа полиэтилена. Считается, что расшатывание массивных эндопротезов связано с механической причиной: подвижностью на границе кость — имплантат.
Для эндопротеза тазобедренного сустава Сиваша К.Шерепо выделил 2 типа АН: 1) механическая, обусловленная интенсивностью и длительностью пускового фактора (когда нагрузка превышает адаптационные механизмы, возможности физиологической и репаративной регенерации); возникает в сроки до 3 лет после операции; 2) металлозная, связанная с взаимодействием окружающей имплантат ткани и продуктами износа; возникает через 7 и более лет после операции. Автор отмечает, что с 1-м типом АН можно бороться консервативно, т.е. изменить условия работы, уменьшить нагрузку на конечность. В лечении 2-го типа АН чаще показано реэндопротезиро . читать далее


ВОССТАНОВИТЕЛЬНАЯ ХИРУРГИЯ
Лекция 26
Профилактика злокачественных опухолей.
Профилактику в онкологии следует рассматривать как ряд мероприятий, направленных на предупреждение возникновения злокачественных опухолей или на предупреждение прогрессирования злокачественного роста.
Она складывается из нескольких этапов.
1 этап – предупреждение развития избыточных клеточных пролифераций с атипией эпителия, которые чаще проявляются на фоне хронического воспалительного процесса или гормональных гиперплазий. Профилактика на этом этапе включает широкие оздоровительные мероприятия.
2 этап – своевременное выявление и адекватное лечение уже возникших избыточных клеточных пролифератов с атипией и сформировавшихся пребластоматозных состояний. Если больной не подвергается лечению, он подлежит регулярному диспансерному наблюдению.
3 этап – предупреждение прогрессирования уже возникшей злокачественной опухоли путем своевременного применения радикального лечения.
К тому же профилактика злокачественных опухолей может проводиться по трем направлениям:
Индустриальный путь – строительство и усовершенствование таких предприятий, городов, двигателей, рабочих и жилых помещений, где человек имел бы минимальный контакт с вредными канцерогенными веществами.
Гингиенический путь – создание условий труда и быта, способствующих оптимальному проявлению нормальных физиологических процессов в оргаизме. Соблюдение правил личной гигиены – одно из основных средств профилактики злокачественных опухолей.
Клинический путь – наблюдение за больными с предбластоматозными заболеваниями.
(пластические операции)
Патологические процессы, развивающиеся в органах и тканях организма человека, нередко приводят к значительному разрушению последних и для спасения жизни больного хирурги часто вынуждены удалять пораженную ткань органа или весь орган. Удаление органа или его части зачастую приводит к значительным нарушениям функции системы органов, к которой данный орган относится, или к нарушению функции самого органа. Поэтому хирурги уже на заре становления хирургии стали стремиться к восстановлению функции органов и систем, замещению утраченных тканей и органов. Так появился большой раздел хирургии, который получил название восстановительная хирургия.
Как справедливо отмечал один из основоположников отечественной восстановительной хирургии Н.А.Богораз каждый орган (система органов) имеет три главных свойства: анатомический образ, физиологическую сущность и функцию. Для восстановительной хирургии присуще стремление восстановить все эти свойства, присущие органу или системе органов. При этом следует отметить, что чем важнее и сложнее функция органа, тем более он должен походить на нормальный орган. Однако добиться такого полного восстановления органа на практике обычно не удается и мерилом полноты восстановления является прежде всего функция, а затем и анатомический образ.
Восстановление функции и образа органа способствует тому, что в какой-то степени восстанавливается и физиологическая основа, что позволяет организму приспособиться к своему новому состоянию.
В зависимости от того, каким способом происходит восстановление свойств органа или его ткани, в восстановительной хирургии используются: реконструктивные операции (способы), собственно восстановительные операции – операции реплантации и трансплантации и пластические операции (способы).
Реконструктивные операции
имеют своей целью главным образом восстановить физиологическую сущность какой-либо системы органов, которая была нарушена в процессе хирургического вмешательства на одном из органов этой системы. Примером реконструктивных операций могут быть оперативные вмешательства на желчевыводящих путях для восстановления пассажа желчи из печени в желудочно-кишечный тракт – билиодигестивные анастомозы.
Восстановительные операции
направлены на полное восстановление органа (операции реплантации части органа при его травме) или замену неработающего органа таким же органом (операции трансплантации).
Пластические операции
ставят перед собой задачу восстановление формы и функции какого-либо органа или искаженной поверхности человеческого тела. Это восстановление может быть осуществлено за счет тканей самого больного – аутопластика, за счет тканей, взятых у другого человека – гомопластика или у животного – гетеропластика. Восстановление может быть осуществлено с использованием и неорганического материала – пластмассами, металлом и др. – аллопластика.
К пластическим операциям относится большая группа косметических операций, имеющих целью восстановление или изменение формы носа, губ, ушных раковин, устранение появляющихся морщин и т.д.
Поскольку в клинической практике чаще всего приходится выполнять пластические операции, им и будет посвящена настоящая лекция.
Термин пластическая хирургия обозначает способ, которым осуществляется восстановление функции и формы органа. Исторически он возник раньше термина восстановительная хирургия. При этом производимые в глубокой древности пластические операции не ставили целью восстановление функции органа.
Восстановительные операции пластическими методами выполняли еще в древности. Тибетские врачи за 3000 лет до н.э. применили кожную пластику для закрытия дефекта носа (ринопластика). В индийской книге Сушруты (за 1000 лет до н.э.) подробно описывается пластика носа лоскутом на ножке, выкроенном из кожи лба или щеки (индийский метод кожной пластики). В древней Индии применяли и свободную кожную пластику.
Известно, что в те времена восстановление носа производилось в Древнем Египте, Риме, Греции. Поводом для развития кожной пластики у древних народов, видимо, послужил обычай отрезать уши и нос у преступников или военнопленных.
В Европе пластическая хирургия начала развиваться в эпоху Возрождения. В Италии в 1450 году военный врач Brancko начал выполнять ринопластику местными тканями (кожа лба, щек) и передал искусство пластики своему роду. Его сын Антоний для пластики применял лоскут из кожи плеча, т.е. использовал методику переноса лоскута из отдаленного от лица участка кожи с помощью ножки. В дальнейшем этот метод для пластики дефекта носа и губ бал разработан итальянским врачом Taliakozzi и опубликован в 1597 году. Он вошел в историю восстановительной пластической хирургии под названием «итальянского способа».
Расцвет пластической хирургии относится к Х1Х – ХХ в.в. Благодаря работам J.Reverdin,(1869), С.М.Янович-Чайнского (1870), Tiersch (1886), И.Я.Фомина (1890), Krause (1893) и др. были освоены различные методы свободной кожной пластики. Большое значение для развития восстановительной хирургии имел предложенный В.П.Филатовым метод пластики кожи при помощи круглого стебля (1917). Очень много работ, посвященных разработке методов свободной кожной пластики, принадлежит Ю.Ю.Джанелидзе. Он систематизировал методы пересадки кожи и восстановил приоритет отечественных хирургов в некоторых вопросах кожной пластики.
В 1670 году Job Mickren сообщил об удачной пересадке собачьей кости в дефект черепа человека. Это сообщение явилось первой работой по костной пластике. В дальнейшем исследованиями Ollier (1859), Е.И.Богдановского (1861), Н.И.Пирогова (1865), М.М.Руднева (1880) и др. были выяснены важнейшие теоретические и практические вопросы, связанные со свободной ауто- , гемо- и гетеропластикой костной ткани. В 1852 году Н.И.Пирогов произвел первую костно-пластическую операции при ампутации стопы.
Экспериментальными и клиническими работами Н.Н.Петрова, А.А.Немилова, Н.А.Богораза, П.Г.Корнева, Lexer, Bier, Kirschner доказали целесообразность применения костной пластики при лечении переломов костей, а также при лечении ложных суставов и других заболеваний костей.
В далеком прошлом для исправления формы носа применяли золотые просверленные пластинки. Однако из-за большого веса их и медленного вживления в ткани они нередко смещались, вызывали пролежни в тканях и выходили наружу. В конце Х1Х в начале ХХ в.в. для тех же целей стали широко применять парафин в расплавленном виде, но из-за трудности дозировки давления при его впрыскивании в ткани наблюдались случаи слепоты и закупорки сосудов сетчатки глаза. К тому же введенный парафин часто изменял свою форму. В настоящее время для пластических целей парафин не применяют.
В 30-40 годы ХХ столетия для аллопластики стали применять пластмассу (АКР-7, АКР-12 и др.), которая хорошо вживалась в ткани. Благодаря своей эластичности, безвредности для организма больного и доступности пластмасса нашла применение в ринопластике, отопластике, для замещения дефектов в костях черепа, замены суставных головок плечевой и бедренной костей. В качестве пластического материала для аллопластики применяется нержавеющая сталь, тантал, виталиум. Эти металлы нашли широкое применение в пластической травматологии.
В 1902 г. Karrel и Morel впервые доказали возможность выполнения пластики артерий аутовеной. В 1909 году А.И.Морозова произвела 10 пересадок артерий в вену. С тех пор аутопластика сосудов стала быстро распространяться среди пластических хирургов.
В то же время хирургов не оставляет мысль об использовании гомопластики сосудов. В 1909 году А.И.Морозова выполнила в эксперименте гомопластическую пересадку артерии в артерию. В последующем гомопластика сосудов нашла широкое применение, как в нашей стране, так и за рубежом. Однако трудности заготовки гомотрансплантатов, возникающие при операции реакции несовместимости ткани донора и реципиента привели к внедрению в пластическую хирургию сосудов методов аллопластики. Для этого стали использовать различные синтетические материалы – ивалон, нейлон, орлон, тефлон, дакрон. При участии профессора Томаса Эдмана из Филадельфийского текстильного института разрабатываются гибкие, вязаные, не имеющие шва трубки из дакрона, которые отвечали всем требованиям пластической хирургии сосудов. Эти протезы легко стерилизовались в автоклаве, их легко можно было резать ножницами или скальпелем, что позволяло моделировать сосуд. Кроме того, они гибки и эластичны, их можно пережимать зажимом, не повреждая ткань протеза. Этими протезами можно было протезировать любой сосуд.
Развитие сердечно-сосудистой хирургии, внедрение в хирургическую практику аппарата искусственного кровообращения позволило разработать пластические операции на клапанном аппарате сердца. Первые сообщения о протезировании клапанов сердца появились в медицинской литературе в 50-х годах ХХ столетия. Пионером в этой области был Hafnagel. В 1958 году Lillehei впервые в мире выполнил имплантацию клапанного протеза в устье аорты у больной с аортальным пороком сердца в условиях искусственного кровообращения. С этого времени начинается внедрение в клиническую практику операций протезирования клапанов сердца. В качестве пластического материала для изготовления клапанов сердца использовали биологические ткани (перикард, клапаны легочных артерий, сухожильную часть диафрагмы), взятые как у человека, так и у животного. Однако клиническая практика показала, что ауто- и гомотрансплантаты теряют свою эластичность, подвижность, сморщиваются на почве фиброза. Поэтому в настоящее время предпочтение отдают аллопластическим протезам.
Аллопластика находит широкое применение и в пластической хирургии грыж передней брюшной стенки, особенно в тех случаях, когда имеет место большая рецидивная грыжа брюшной стенки. В этих случаях часто используется капроновая сетка. Пластические материала в виде хлорвиниловых протезов и капроновых каркасов находят широкое применение в пластической хирургии пищевода, желчных путей, диафрагмы.
Не нашли то, что искали? Воспользуйтесь поиском:
Операции на суставах
Операции на суставах необходимо выполнять с учетом их анатомо-физиологических особенностей, легкой ранимостью и восприимчивостью к инфекции, а также с использованием оперативных доступов, щадящих околосуставные образования и связочный аппарат. На суставах выполняют следующие операции: пункцию, артротомию, артролиз, артрориз, артродез, артропластику, резекцию, пластику или замещение удаленных суставов.
Артротомия – вскрытие полости сустава. Выполняется с целью дренирования полости сустава при гнойно-воспалительных заболеваниях или с целью оперативного доступа для выполнения какой-либо операции на суставе.
Артролиз – операция направленная на иссечение фиброзных спаек в полости сустава. Показанием к операции является контрактура сустава. Операцию производят при сохраненных суставных поверхностях пораженных костей. Этапы операции: артротомия, рассечение спаек, установление суставных концов костей в правильном положении, помещение между ними лоскута жировой ткани, для предупреждения образования новых сращений. После операции наступает частичное восстановление подвижности сустава, однако возможны рецидивы.
Артропластика – операция, направленная на восстановление подвижности сустава, либо создание условий, препятствующих образованию анкилоза после резекции сустава. Артропластика на суставах руки более эффективна (они статистически менее нагружены), чем на суставах ноги. С появлением искусственных суставов интерес к классической артропластике значительно снизился. Однако в молодом возрасте эта операция иногда является операцией выбора. Этапы артропластики:
2. Разъединение суставных поверхностей по суставной щели, моделирование или создание формы костных концов близкой к нормальной конфигурации сустава.
3. Укрытие суставных поверхностей пластинкой широкой фасции бедра.
4. Иммобилизация конечности.
5. Разработка сустава.
Артродез – оперативное вмешательство, направленное на искусственное создание анкилоза (неподвижности сустава) в удобном для конечности положении. Показаниями для этой операции являются патологическая подвижность или разболтанность в суставе. Выделяют несколько способов артродеза:
1. Внутрисуставной – операция выполняется со вскрытием полости сустава и заключается в резекции суставных поверхностей или нанесении на них шероховатостей, соединение их с помощью шурупов, гвоздей с последующей иммобилизацией конечности в функционально выгодном положении.
2. Внесуставной – неподвижность в суставе создается без его вскрытия путем параартикулярного введения костного трансплантата или экстракапсулярной фиксации суставных поверхностей с помощью металлических пластинок.
3. Комбинированный – сочетание внутри- и внесуставного.
В настоящее время часто применяют компрессионный артродез, когда суставные поверхности фиксируются с помощью компрессионных аппаратов.
При параличе отдельной группы мышц на суставах выполняют операцию артрориза. Это вмешательство направлено на ограничение амплитуды движения или подвижности в суставе. Принцип операции состоит в создании «ограничителя» движений в суставе. В качестве «ограничителей» могут использоваться костные или металлические пластинки. Чаще всего операцию артрориза производят на голеностопном суставе при так называемой «конской стопе», которая наблюдается при повреждении общего малоберцового нерва или его глубокой ветви. В этих случаях выполняют задний артрориз – костную пластинку размещают между пяточным бугром и большеберцовой костью. Иногда вместо костных пластинок для ограничения подвижности в суставе применяют сухожилия, такая операция называется тенодезом. Однако, в последнее время из-за рецидивов, которые возникают после операции тенодеза, стали чаще использовать лавсановые ленты – лавсанодез.
При ранениях, гнойных поражениях, туберкулезе, злокачественных новообразованиях суставов выполняется операция резекция сустава. В зависимости от объема удаления суставных поверхностей резекция сустава может быть:
— экономной, когда удаляются только хрящевые поверхности эпифизов;
— полной, когда удаляются суставные концы костей вместе с хрящами и синовиальной оболочкой.
В зависимости от техники выполнения выделяют:
— внутрисуставную или интракапсулярную резекцию, при которой вскрывается полость сустава;
— внесуставную или экстракапсулярную, когда полностью удаляют единым блоком эпиметафизы обеих костей вместе с капсулой без вскрытия полости сустава.
После выполнения резекции сустава развивается анкилоз. Однако, резекция сустава может быть и первым этапом операции эндопротезирования – пластики сустава. В настоящее время широкое распространение получили металлополимерные протезы различных суставов. Алло- и ксенотрансплантаты суставов используются редко.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: При сдаче лабораторной работы, студент делает вид, что все знает; преподаватель делает вид, что верит ему. 9327 —



| Видео (кликните для воспроизведения). |
 |
История лечения: Как Дмитрий Николаев избавился от боли в суставах |
185.189.13.12 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
Лечебно-диагностические центры
Центр травматологии и ортопедии (подробно)
История центра
Зарождение ЦТиО ГВКГ им. Н.Н. Бурденко было неразрывно связано с историей 3 хирургического отделения госпиталя, которое явилось его непосредственным предшественником.
Во время Великой Отечественной войны отделение занималось восстановительной хирургией. С 1945 г., когда отделению был определен травматологический профиль, оно было развернуто на 40 коек. Начальником отделения назначен А.А. Гусев; с 1953 г. им был В.Т. Леонов, а с 1972 г. – В.В. Черкашин.
С 1985 по 1995 г. 3 травматологическое отделение, а с 1995 возглавил центр травматологии и ортопедии полковник медицинской службы Николенко Владимир Кузьмич. Под его руководством продолжалась реализация сложной и многоплановой программы по дальнейшему совершенствованию лечения раненых и больных травматологического профиля.
Начальник центра
С 2009 г. начальником ЦТиО является доктор медицинских наук, профессор кафедры хирургии с курсами травматологии, ортопедии и хирургической эндокринологии НМХЦ им. Н.И Пирогова, врач высшей категории полковник медицинской службы Брижань Леонид Карлович. Выпускник Военной-медицинской академии им. С.М. Кирова.

В 2010 г. защитил докторскую диссертацию на тему: «Система лечения раненых с огнестрельными переломами длинных костей конечностей»
Автор более 100 научных работ, 2 монографий, 9 изобретений.
Сотрудники центра
В центре работают 17 травматологов-ортопедов, из них 2 д.м.н., 6 к.м.н., 8 специалистов высшей категории.
Структура ЦТиО:

Ежегодно в центре находится на стационарном лечении от 1200 до 1500 пациентов. При этом в структуре поступающих количество раненых с огнестрельными повреждениями опорнодвигательного аппарата ежегодно составляет 8-10%, а сочетанной и множественной травмой – до 12% случаев.
В течение 2005-2011 гг. в центре был проведен капитальный ремонт отделений, операционного отделения на уровне мировых стандартов.
Центр оснащен современным оборудованием, позволяющим добиваться максимально возможных степеней восстановления анатомии и функции опорно-двигательного аппарата.
Больным предоставляются двух- и четырехместные палаты, палаты люкс со всеми удобствами.
Центр является клинической базой усовершенствования травматологов-ортопедов (Военно-медицинская академия им. С.М. Кирова).
3 травматологическое (острой травмы) отделение
История отделения
В 1945 г. и развернуто на 40 коек. С 1995 г. отделение вошло в состав Центра травматологии и ортопедии как травматологическое (неотложное).
Начальник отделения
В настоящее время 3 травматологическим отделением руководит врач высшей категории подполковник медицинской службы Керимов Артур Асланович

51 (реконструктивно-восстановительное) отделение
Отделение основано в составе ЦТиО ГВКГ им. Н.Н. Бурденко летом 1995 г. В настоящее время руководит отделение подполковник медицинской службы, врач высшей категории, Петров В.К. Окончил Военное-медицинскую академию в 1998 г. клиническую ординатуру по травматологии и ортопедии при ГИУВ МО РФ. С 2001 г. активно занимается эндопротезированием, артроскопией крупных суставов, лечения больных с травмами и последствиями ранений, доброкачественными опухолями костной ткани. Автор более 30 научных работ.

55 ортопедическое отделение
Отделение основано в составе Центра травматологии и ортопедии ГВКГ им. Н.Н. Бурденко в 1995 г.
Заведующий отделением — кандидат медицинских наук, врач травматолог-ортопед высшей категории Буряченко Борис Павлович. Окончил Военное-медицинскую академию и клиническую ординатуру при кафедре Военной травматологии и ортопедии. С 1993 года занимается эндопротезированием крупных суставов. Автор более 100 научных работ.

64 травматологическое отделение хирургии позвоночника
Отделение основано в составе Центра травматологии и ортопедии ГВКГ им. Н.Н. Бурденко летом 2005 г. Отделение является единственным специализированным штатным в Вооруженных Силах РФ для оказания помощи пациентам с патологией позвоночника травматологического профиля. Развернуто 15 коек в штатном помещении и рассчитано на оказание комплексной, современной высокотехнологичной помощи, включающей все виды хирургического лечения пациентов со всем спектром патологии позвоночника: травма позвоночника и ее последствия, дегенеративно-дистрофические заболевания позвоночника (стеноз позвоночного канала, грыжи межпозвонковых дисков, спондилолистезы), деформация позвоночника (сколиозы, кифозы), онкологические заболевания (гемангиомы, опухоли, ментастазы), воспалительные заболевания позвоночника (дисциты и спондилиты).
Отделение оснащено всем необходимым современным оборудованием и инструментарием для выполнения всех видов хирургических операций на позвоночнике, в т.ч малоинвазивных. В отделение выполняется ежегодно около 250 высокотехнологичных операций. Имеются палаты повышенной комфортности на 1-4 койки, которые оборудованы системой экстренного вызова, санузлами с душевыми кабинками, телевизорами, холодильниками.

Заведующий отделением кандидатом медицинских наук, врач высшей категории Козлов Григорий Николаевич занимается проблемой хирургического лечения больных с различными заболеваниями и повреждениями позвоночника. Прошел обучение в ведущих российских и зарубежных клиниках. Активно участвует в национальных и международных научно-практических конференциях, конгрессах и съездах. Опубликовал около 50 научных статей и 3 методических пособия.
Операционное отделение
На сегодняшний день, операционное отделение центра насчитывает в себе 4 операционных, работающих как в плановом порядке, так и экстренном режиме.
Все операционные оснащены современным высокотехнологичным оборудованием с навигационным компонентом. Следует отметить, что оборудование операционного отделения, не только уступает некоторым широко известным мировым клиникам, но ив некоторых областях превосходит их. Причем, ряд комплектов аппаратуры выпускается отечественным производителем и не имеет аналогов в мире.
В целом, оборудование операционного отделения позволяет с уверенностью выполнять различные вмешательства на всех отделах опорно-двигательного аппарата с соблюдением принципов малотравматичности, компьютерной навигации, артроскопии, визуального и рентген-контроля.
Операционные непрерывно оснащаются всем необходимым хирургическим и диагностическим оборудованием ведущих мировых производителей последнего поколения:
- удобным высокоточным хирургическим инструментарием;
- потолочными анестезиологическими и хирургическими консолями;
- высокочастотными аппаратами для электрохирургии с применением аргоноплазменных технологий;
- системами позиционирования и навигации для выполнения операций;
- мобильными рентген-аппаратами ;
- эндоскопическими стойками;
- современными многофункциональными операционными столами;
- высококлассными и безопасными расходными материалами;
- автономной системой энергоснабжения и вентиляции на случай чрезвычайных обстоятельств.
РАННЕЕ ВОССТАНОВИТЕЛЬНОЕ ЛЕЧЕНИЕ БОЛЬНЫХ ПОСЛЕ РЕКОНСТРУКТИВНО-ПЛАСТИЧЕСКИХ ОПЕРАЦИЙ НА ТАЗОБЕДРЕННОМ СУСТАВЕ
© Алексеева М.В., Майрина Т.П., 2013
Поступила 11.03.2013 г.
М.В. АЛЕКСЕЕВА,
Т.П. МАЙРИНА
РАННЕЕ ВОССТАНОВИТЕЛЬНОЕ ЛЕЧЕНИЕ БОЛЬНЫХ
ПОСЛЕ РЕКОНСТРУКТИВНО-ПЛАСТИЧЕСКИХ ОПЕРАЦИЙ
НА ТАЗОБЕДРЕННОМ СУСТАВЕ
Городская клиническая больница №1, Чебоксары
Рассмотрены вопросы повышения эффективности восстановления пациентов в раннем послеоперационном периоде после реконструктивно-пластических операций на тазобедренном сустав путем применения комплекса методов физической реабилитации. Представлены особенности реабилитационных мероприятий, проводимых в травматологическом отделении №1 БУ «Городская клиническая больница №1». Разработаны и предложены комплексы лечебной гимнастики и методы физиотерапевтических воздействий пациентам, перенесшим эндопротезирование тазобедренного сустава. Комплексы реабилитационных мероприятий разработаны с учетом различных периодов реабилитации.
Ключевые слова: реабилитация, тазобедренный сустав, кинезотерапия, физиотерапия.
Введение. Значительная распространенность заболеваний и травм тазобедренного сустава, стойкость нарушений функций сустава, сопровождающиеся длительной утратой трудоспособности, превращают медицинскую реабилитацию в важнейшую проблему здравоохранения.
Количество заболеваний и повреждений тазобедренного сустава, по прогнозам ВОЗ, будет расти с увеличением продолжительности жизни и общим старением населения. В 2000 г. во всем мире количество лиц в возрасте 60 лет и старше составило 590 млн человек, а к 2025 – превысит один миллиард. Удельный вес заболеваний и повреждений тазобедренного сустава среди патологии опорно-двигательной системы возрастет на 80% [7].
С.Х. Курбанов (2009) отмечает, что дегенеративно-дистрофические поражения тазобедренного сустава занимают первое место среди аналогичных заболеваний других суставов. Анализ статистических данных показывает, что в разных странах Европы частота коксартроза среди взрослого населения колеблется от 7 до 25%. Инвалидность при этом составляет 60% [1, 4].
При выборе метода хирургического вмешательства в III и IV стадиях коксартроза и гонартроза большинство хирургов отдают предпочтение эндопротезированию. В Федеральном государственном бюджетном учреждении «Федеральный центр травматологии, ортопедии и эндопротезирования» проводится высокотехнологичное хирургическое лечение пациентов с заболеваниями и травмами опорно-двигательного аппарата. Лечебные программы выполняются с использованием самых современных медицинских технологий. Лечение всегда планируется с учетом индивидуальных особенностей пациента: его возраста, степени тяжести и хода заболевания, сопутствующих заболеваний, дальнейших перспектив трудовой и социальной активности. Однако после операции важнейшей задачей является восстановление функции вновь созданного звена опорно-двигательного аппарата.
Поскольку к моменту операции у больного имеется длительно существующий комплекс костно-мышечной патологии, реабилитация пациента, перенесшего операцию тотального эндопротезирования тазобедренного сустава, требует особого подхода и значительных усилий как со стороны пациента, так и со стороны врачей-реабилитологов [1, 2, 3, 5, 6]. Следует помнить, что операция является лишь этапом длительного процесса лечения, а для дальнейшего стойкого закрепления результатов операции восстановительная терапия должна быть своевременной, комплексной и преемственной на разных ее этапах.
Медицинская реабилитация в послеоперационном периоде разбита на несколько этапов (табл. 1).
Периоды и двигательные режимы послеоперационного восстановительного лечения
Периоды восстановительного лечения
Двигательный режим
Срок после операции
Характеристика периода
С 1 — 2 до 5 — 7 дня
Острое послеоперационное реактивное воспаление
С 5 — 7 до 15 дня
Заживление послеоперационной раны
С 15 дня до 6 — 8 недель
Преобладание процессов резорбции разрушенных костных структур
С 6 — 8 до 10 недель
Преобладание процессов регенерации костной ткани
С 10 — 12 недель
Ремоделирование костной ткани
При применении индивидуального подхода на каждом из этапов реабилитации с учетом индивидуальных характеристик больного происходит постепенная перестройка костной структуры соответственно изменяющимся условиям опорно-весовой нагрузки, снижается нагрузка на другие сегменты опорно-двигательной системы.
Пациенты после операции переводятся в травматологическое отделение №1 (Бюджетного учреждения «Городская клиническая больница №1») на 7 сутки после операции для проведения дальнейшей комплексной системной реабилитации. Сотрудники в процессе комплексной реабилитации в раннем послеоперационном периоде после эндопротезирования тазобедренного сустава ставят перед собой следующие задачи:
· Заживление послеоперационной раны.
· Максимально возможное устранение гипотрофии мышц бедер, ягодиц, голени. Капсула сустава, иссеченная в ходе операции, восстанавливается медленно, и головка эндопротеза удерживается в вертлужном компоненте сустава только окружающими мышцами. Хорошее состояние мышц предотвращает в дальнейшем развитие остеопороза и нестабильности, сопровождающихся болевым синдромом и нарушением опорной функции.
· Восстановление двигательных функций конечности как органа опоры и движения.
· Профилактика и лечение развивающихся после операции нейропатий седалищного или бедренного нервов.
· Профилактика образования кальцинатов мягких тканей, сопровождающихся болевым синдромом и ограничением функции суставов нижней конечности.
· Улучшение трофики тканей оперированной конечности.
· Декомпрессия тканей оперированного сустава.
· Укрепление мышц неповрежденной конечности, поскольку в раннем послеоперационном периоде основная нагрузка при ходьбе ложится на здоровую конечность.
· Восстановление и сохранение двигательной активности неповрежденных звеньев опорно-двигательного аппарата.
· Возмещение временно утраченных или ослабленных органов опоры и передвижения.
· Компенсация соматической патологии и возможных послеоперационных осложнений.
· Подготовка больного к лечению в амбулаторных условиях.
Медикаментозная профилактика тромбозов и флебитов в травматологическом отделении №1 проводится до полной активизации больного и исчезновения клинических симптомов нарушения кровообращения в конечностях. Кроме того, с той же целью проводится ЛФК, бинтование эластичным бинтом от основания пальцев до верхней трети бедра.
В целях предупреждения нагноения мягких тканей проводится антибиотикопрофилактика препаратами широкого спектра действия.
Профилактику развития сердечно-сосудистой недостаточности, инфаркта миокарда и гипертонического криза с нарушением мозгового кровообращения осуществляют за счет тщательного динамического контроля и проведения предупредительной терапии кардиотропными и диуретическими средствами, своевременной и полной коррекции гиповолемии, нарушений свертывающей системы крови, работы сердца, уровня артериального давления, электролитного баланса.
Для профилактики гипостатической пневмонии проводится дыхательная и общеукрепляющая гимнастика, но наиболее эффективным профилактическим средством при нормальном течении послеоперационного периода является ранняя активизация больных.
Из физиотерапевтических воздействий с целью профилактики ранних послеоперационных осложнений, прежде всего воспалительного характера, на область раны назначаются 5-7 сеансов УВЧ-терапии или магнитотерапии, которые оказывают противовоспалительное, противоотечное и обезболивающее действие. Процедуры проводят в палате с помощью переносных аппаратов без снятия повязки (она должна быть сухой, особенно при УВЧ-терапии). Учитывая наличие металлоконструкции (эндопротез), обычно применяется электромагнитное поле УВЧ по продольной методике, при которой электроды-излучатели располагают таким образом, чтобы силовые линии электромагнитного поля, идущие от одного электрода к другому, проходили вдоль металлической конструкции. При наличии противопоказаний к УВЧ- или магнитотерапии можно провести с той же целью ультрафиолетовое облучение области швов (например, во время перевязок).
В стадии эпителизации раны применяются ультрафиолетовое облучение (УФО) раны, лазеротерапия, лечение поляризованным светом или дарсонвализация.
При наличии болевого синдрома (боли в области операции невоспалительного характера, иррадиирующие боли по ходу нервных стволов) назначаются процедуры диадинамотерапии, амплипульстерапии или электрофореза с обезболивающими средствами. Конкретные методики определяет врач-физиотерапевт.
В реабилитации больных после операции большое значение имеет массаж. Его начинают с неоперированной конечности на 3-5 сутки. Он особенно показан при двустороннем поражении тазобедренных суставов, увеличение нагрузки на здоровую ногу может быстро привести к декомпенсации и нарушению ее опороспособности. С14-17 суток начинают массаж оперированной конечности.
С целью укрепления мышц применяется миоэлектростимуляция (МЭС): ягодичных мышц, мышц бедра (четырехглавой и отводящих), при необходимости — мышц голени.
МЭС на здоровой ноге начинают на 3-5 день после операции, на оперированной — после снятия швов. Наиболее эффективна активно-пассивная методика, при которой больной принимает активное участие в процедуре, сокращая дополнительно (или пытаясь сократить) волевым усилием стимулируемую мышцу одновременно с подачей электрических импульсов. Эта методика позволяет мобилизовать центральную нервную систему и тем самым усилить весь комплекс обменно-трофических процессов, направленных на обеспечение работающих мышц (табл. 2).
Большое значение для восстановления нарушенных травмой и операцией функций опорно-двигательного аппарата имеет механотерапия. Использование аппарата «ARTROMOT-K-1» для пассивной разработки коленного и тазобедренного суставов начинается со вторых суток после операции. Его применение позволяет получить безболезненные и хорошо отрегулированные движения, расслабить оперированную конечность во время занятий, точно установить диапазон движений и скорость выполнения упражнений, снизить риск тромбоэмболических осложнений после операций.
Методики и ориентировочные сроки процедур после эндопротезирования тазобедренного сустава, проводимых в травматологическом отделении №1
Процедура
Сутки после операции
| Видео (кликните для воспроизведения). |
|
Доктор С.М.Бубновcкий подтверждает силу препарата... Читать далее >>> |
Э/п УВЧ или магнитотерапия (10-15 минут, курс 7 -10) на область оперированного сустава
Электростимуляция четырехглавой и ягодичных мышц оперированной конечности
Источники
-
Мазнев, Н. Варикоз, подагра и другие болезни ног. 700 проверенных рецептов / Н. Мазнев. — М. : Рипол Классик, 2011. — 557 c. -
Доктор Евдокименко Артроз тазобедренных суставов. Уникальная исцеляющая гимнастика / Доктор Евдокименко. — М. : Мир и Образование, 2013. — 512 c. -
В. И. Иоффе Иммунология ревматизма / В. И. Иоффе. — М. : Государственное издательство медицинской литературы, 1984. — 356 c.